解读|如何避免出口防疫物资被召回、退货(防护服出口信息指南)中,下面跟着瀚而普出口外贸代理小编一起来看看吧!更多出口外贸代理欢迎来电咨询瀚而普上海外贸进出口公司,服务热线:021-35383360
三、国外防护服准入条件
(一)美国
非医用防护服由美国国家职业安全卫生研究所(NIOSH)管理,企业直接在NIOSH官网进行注册申请;
医用防护服必须要取得美国食品和药物管理局FDA注册才可以在美国本土市场进行销售。
1.防护服分类
根据防护服不同应用,美国消防协会NFPA和美国材料实验协会ASTM提出并经美国职业安全和健康管理局OSHA认可,将防护服分为以下四个等级(NFPA1999:2018《紧急医疗行动的防护服和装备》):
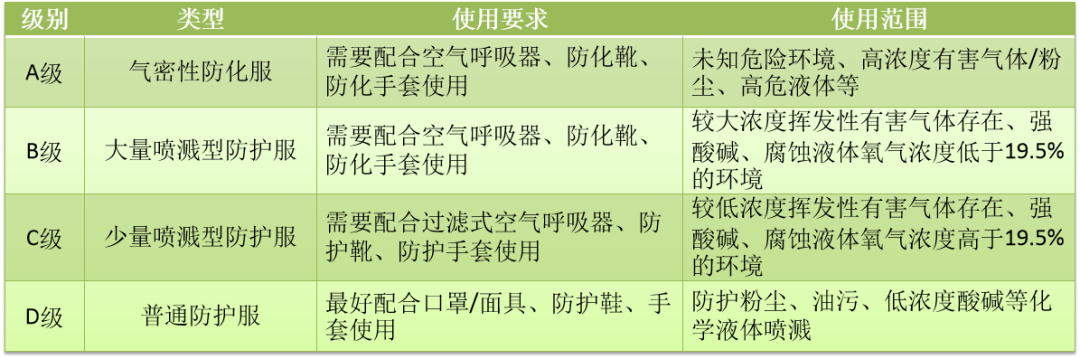
医用防护服可分为非手术防护服和手术用防护服两类。非手术防护服属于I类医疗器械,免于上市前登记,直接进行机构注册。而手术用防护服属于II类医疗器械,需要进行上市前登记,即需要申请FDA 510(K)。

2. 防护服标准
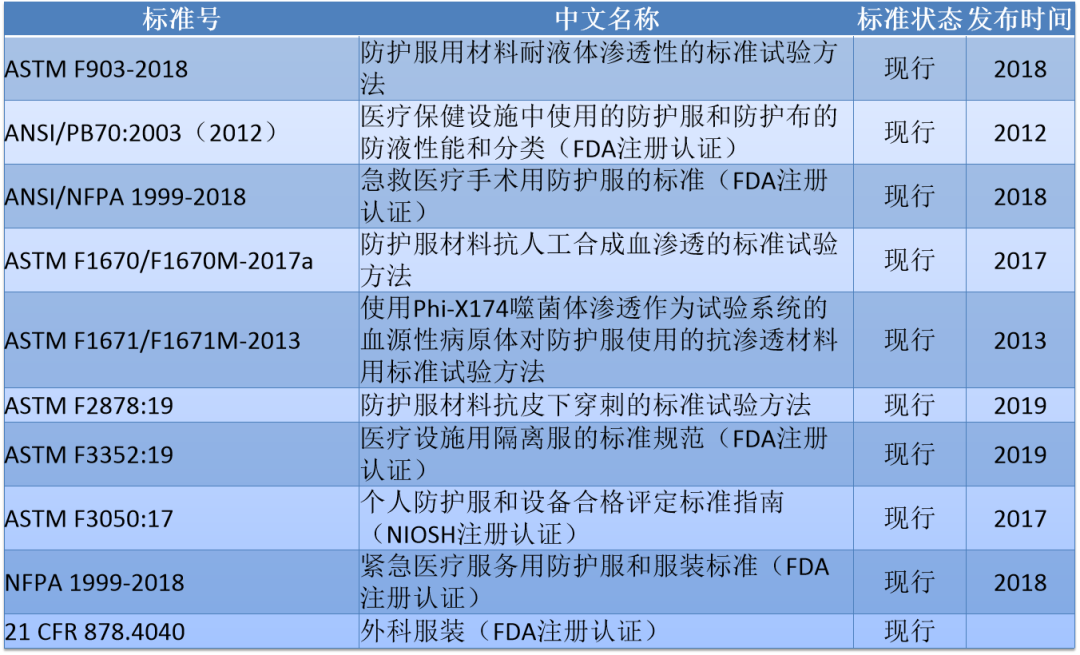
美国市面销售上的防护服也常用ANSI/AAMI PB70的4个级别对产品测试分类。各级别的阻隔性要求见下图:
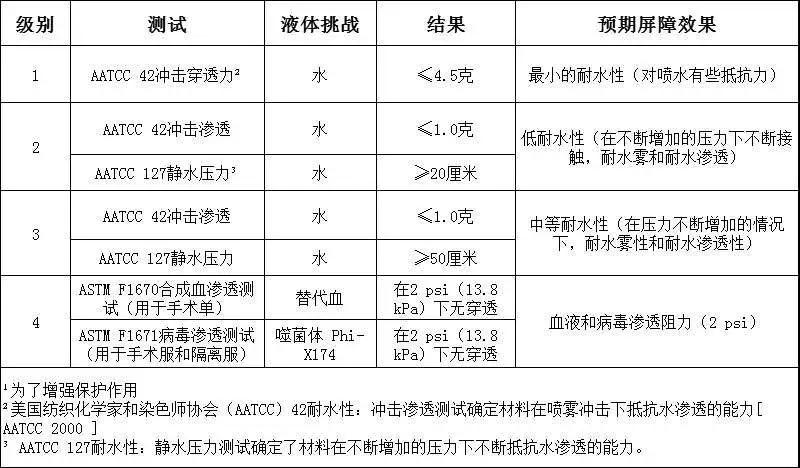
需要重点关注的是,级别1、2和3的要求具有与之相关的特定测试要求,仅对4级防护服进行了抗病毒渗透性测试,因此使用ASTM F1671仅将4级服装视为对病毒渗透不可渗透。符合较低级别(1、2和3级)的防护服不能被认为是不可渗透的,不能用在病原性防护中,只有美标4级才有能力用在此次新冠肺炎疫情的医用防护中。
3. FDA注册需要关注的问题点
问题一:FDA证书是哪个机构发放的?
答:FDA注册是没有证书的,产品通过在FDA进行注册,取得注册号码,FDA会给申请人一份回函(有FDA行政长官的签字),但不存在FDA证书一说。常所说的FDA认证就是指FDA注册号,而FDA也只认这个注册号。我们通常看到的FDA证书是中介代理机构(注册代理)签发给厂家,以证明其帮助该厂家完成了美国FDA要求的“生产设施注册和产品类型注册”(Establishment Registration and Device Listing),完成的标志是帮助厂家取得了FDA的注册登记号。

问题二:FDA需要指定的认证实验室检测吗?
答:FDA作为联邦执法机构,主要负责制定法规和市场监管等。FDA只会对服务性的检测实验室的GMP(英文Good Manufacturing Practice 的缩写,即“良好作业规范”)质量进行认可,合格的颁发合格证书,但不会向公众“指定”或推荐特定的一家或几家。

问题三:FDA注册是否一定需要一位美国代理人?
答:美国FDA规定,国外的医疗器械、食品、酒类、药品等工厂在进入美国之前必须进行注册,同时必须指定一位美国代理人,该美国代理人负责紧急情况和日常事务交流。美国代理人是指在美国或在美国有商业场所,国外工厂为了进行FDA注册而指定其为注册代理人。美国代理人不能只是邮箱、语音电话,或者作为国外工厂代理人的个人地址根本就不存在的场所。
问题四:FDA注册和FDA检测以及FDA认证三者到底有什么区别?
答:严格来讲没有FDA认证的说法。FDA批准一般针对药品比较多,就是允许这个药品上市了;FDA注册就是产品要先到FDA官网注册下,个别产品需要检测;FDA检测是针对与食品直接或间接接触的材料,由第三方根据FDA的公布的法规来做检测,看产品是否符合FDA法规要求。
问题五:FDA注册和CE认证有什么区别?
答:CE认证模式为:产品检测+报告证书,而FDA注册采用的是诚信宣告模式,即:你对自己的产品符合相关标准和安全要求负责,并在美国联邦网站注册,如果产品出事,那么就要承担相应的责任。因此FDA注册对于大部分产品,不存在寄样品检测和出证书的说法。
问题六:FDA注册有效期有多长?
答:FDA注册有效期为一年,如果超过一年,则需要重新提交注册,所涉及的年费也需要重新付。
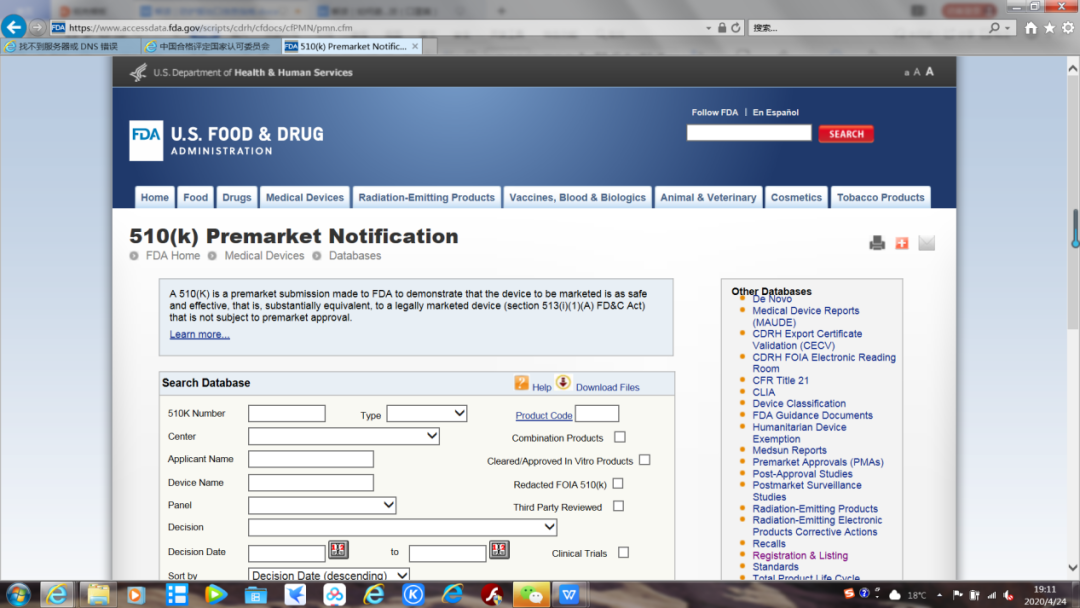
问题七:如何查询产品已经获得FDA列名或510K注册?
答:唯一权威途径就是去FDA官网查询,FDA列名:https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfRL/rl.cfm
510K注册:
https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfPMN/pmn.cfm
(二)欧盟
非医用防护服须获得欧盟CE认证,并符合技术法规(EU)2016/425(PPE),该法规覆盖防护服、呼吸防护设备、手套等产品的安全监管。法规(EU)2016/425(PPE)原文网址如下:https://eur-lex.europa.eu/legal-content/EN/TXT/?qid=1584082251069&uri=CELEX:32016R0425

医用防护服按照医疗器械管理,其中无菌医用防护服需按照欧盟医疗器械指令93/42/EEC(简称MDD)或欧盟医疗器械条例EU2017/745(简称MDR)(注:MDR将于2020年5月26日期正式取代MDD获得CE认证),非无菌医用防护服只需进行CE自我声明。
1.欧盟医疗器械指令93/42/EEC(MDD)授权的公告机构查询地址:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=13
2.欧盟医疗器械条例EU 2017/745(MDR)授权公告机构查询地址:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=34
3.欧盟个人防护装备条例EU2016/425(PPE)授权的公告机构查询地址:
https://ec.europa.eu/growth/tools-databases/nando/index.cfm?fuseaction=directive.notifiedbody&dir_id=155501
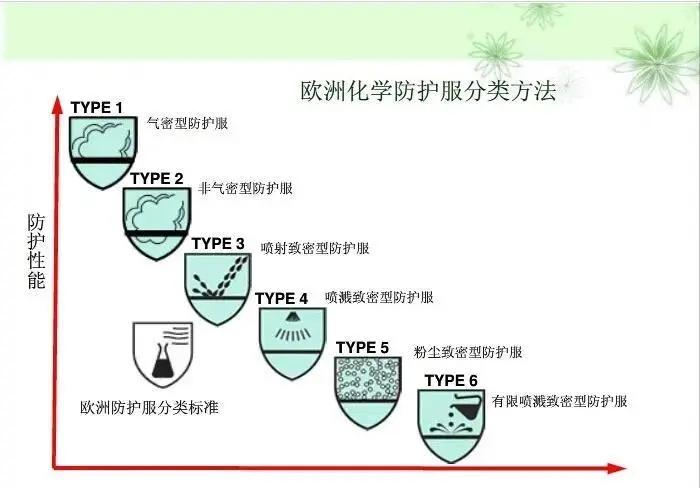
1.防护服分类
按照防护性能分为6类,从type1到type6,数字越小防护越高,type 4为医用推荐要求。
2.防护服标准及对应分类
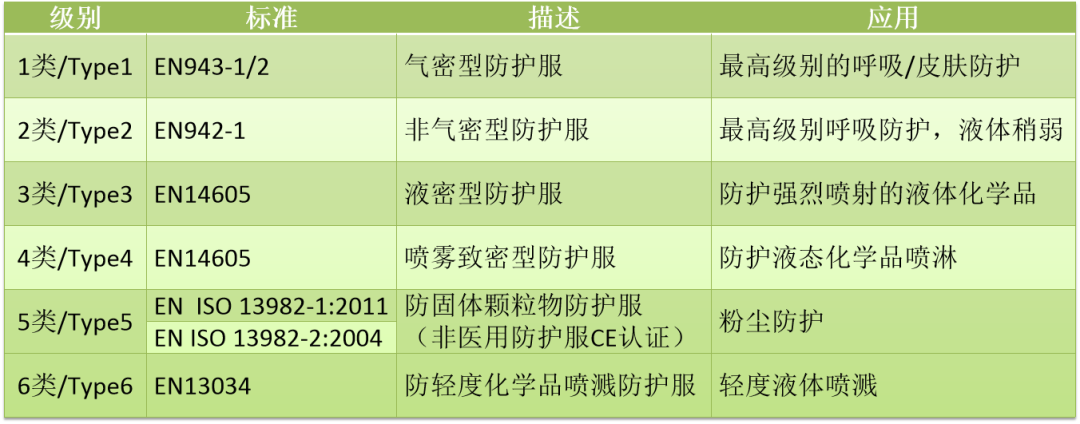
除上述标准之外,特别要说明的是EN 14126:2003+AC-2004 《防护服抗感染防护服的性能要求和试验方法中Type1至Type6的要求》,该标准适用于可重复的和有限使用的防护服;其中要求防护服的接缝处应符合EN 14325《化学药品防护服 化学防护服装材料、缝合线、联结和组合的试验方法和性能分类》中的强度要求。EN 13795-1:2019《外科服装和罩衫.要求和试验方法.第1部分.外科服装和罩衫》、EN 13795-2:2019《外科服装和窗帘.要求和试验方法.第2部分.洁净空气服》适合于外科医生及手术过程中为避免交叉感染的患者穿着用。
3.重点关注
根据抗击新冠疫情期间我国《国家卫生健康委办公厅关于加强疫情期间医用防护用品管理工作的通知》(国卫办医函〔2020〕98号),疫情防控期间,医用防护服不足时,医疗机构可使用紧急医用物资防护服。紧急医用物资防护服应当符合欧盟医用防护服EN14126标准(其中液体阻隔等级在2级以上)并取得欧盟CE认证,或液体致密型防护服(type3,符合EN14605标准)、喷雾致密型防护服(type4,符合EN14605标准)、防固态颗粒物防护服(type5,符合1SO13982-l&2标准)。Type 6 类防护服因为对接缝处没有技术要求,所以接缝和针孔处会造成污染液体的穿透,不适用于新型冠状病毒防护。紧急医用物资防护服仅用于隔离留观病区(房)、隔离病区(房),不能用于隔离重症监护病区(房)等有严格微生物指标控制的场所。

4.CE标志制度
CE标志制度是欧盟对产品进入欧盟市场进行的监管方式。加贴CE标志的产品表明产品符合欧盟有关安全、健康、环保等法规要求,可以在欧盟27个成员国、欧洲贸易自由区的4个国家以及英国和土耳其合法上市销售。
按照欧盟规定,不同产品采用不同的评价方式加贴CE标志,主要有两种方式:绝大部分产品是制造商采取自我符合性声明方式,就可以加贴CE标志;部分风险相对更高的产品需要经过欧盟授权的第三方机构,即公告机构(Notified Body)进行符合性评定后,方可加贴CE标志。
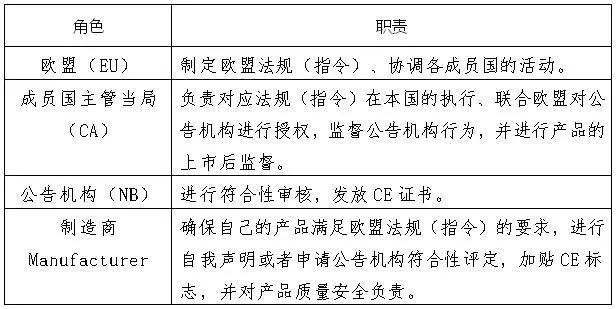
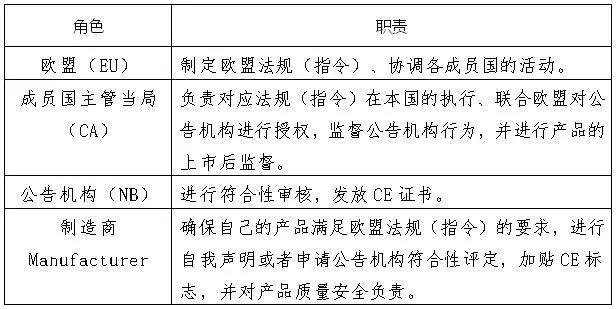
下图列举了欧盟、成员国的主管当局、公告机构和制造商的职责。
国内具备欧盟公告机构防护服等业务资质的认证机构名录(更新至2020年4月13日)
上海瀚而普国际贸易有限公司是一家以进口外贸代理、出口外贸代理及自营各类商品和技术的进出口业务、国际供应链业务为主的专业化、多功能、综合性的出口外贸代理公司,24小时应急响应,提供出口外贸代理、清关等一揽子进出口服务,出口外贸代理热线:021-35383360。
转自网络,如侵删。







 关注瀚而普微信号
关注瀚而普微信号